- Se denomina gas al estado de agregación de la materia en el que las sustancias no tienen forma ni volumen propio, adoptando el de los recipientes que las contienen. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
LAS PROPIEDADES DE LOS GASES
1. Se adaptan a la forma y el volumen del recipiente que los contiene. Un gas, al cambiar de recipiente, se expande o se comprime, de manera que ocupa todo el volumen y toma la forma de su nuevo recipiente.
2. Se dejan comprimir fácilmente. Al existir espacios intermoleculares, las moléculas se pueden acercar unas a otras reduciendo su volumen, cuando aplicamos una presión.
3. Se difunden fácilmente. Al no existir fuerza de atracción intermolecular entre sus partículas, los gases se esparcen en forma espontánea.
4. Se dilatan, la energía cinética promedio de sus moléculas es directamente proporcional a la temperatura aplicada.
Variables que afectan el comportamiento de los gases
1. PRESIÓN
Es la fuerza ejercida por unidad de área. En los gases esta fuerza actúa en forma uniforme sobre todas las partes del recipiente.La presión atmosférica es la fuerza ejercida por la atmósfera sobre los cuerpos que están en la superficie terrestre. Se origina del peso del aire que la forma. Mientras más alto se halle un cuerpo menos aire hay por encima de él, por consiguiente la presión sobre él será menor.
2. TEMPERATURA
Es una medida de la intensidad del calor, y el calor a su vez es una forma de energía que podemos medir en unidades de calorías. Cuando un cuerpo caliente se coloca en contacto con uno frío, el calor fluye del cuerpo caliente al cuerpo frío.
La temperatura de un gas es proporcional a la energía cinética media de las moléculas del gas. A mayor energía cinética mayor temperatura y viceversa.
La temperatura de los gases se expresa en grados kelvin.
3. CANTIDAD
La cantidad de un gas se puede medir en unidades de masa, usualmente en gramos. De acuerdo con el sistema de unidades SI, la cantidad también se expresa mediante el número de moles de sustancia, esta puede calcularse dividiendo el peso del gas por su peso molecular.
4. VOLUMEN
Es el espacio ocupado por un cuerpo.
5. DENSIDAD
Es la relación que se establece entre el peso molecular en gramos de un gas y su volumen molar en litros.
Gas Real
Los gases reales son los que en condiciones ordinarias de temperatura y presión se comportan como gases ideales; pero si la temperatura es muy baja o la presión muy alta, las propiedades de los gases reales se desvían en forma considerable de las de gases ideales.
Concepto de Gas Ideal y diferencia entre Gas Ideal y Real.
Los Gases que se ajusten a estas suposiciones se llaman gases ideales y aquellas que no se les llama gases reales, o sea, hidrógeno, oxígeno, nitrógeno y otros.
1. - Un gas esta formado por partículas llamadas moléculas. Dependiendo del gas, cada molécula esta formada por un átomo o un grupo de átomos. Si el gas es un elemento o un compuesto en su estado estable, consideramos que todas sus moléculas son idénticas.
2. - Las moléculas se encuentran animadas de movimiento aleatorio y obedecen las leyes de Newton del movimiento. Las moléculas se mueven en todas direcciones y a velocidades diferentes. Al calcular las propiedades del movimiento suponemos que la mecánica newtoniana se puede aplicar en el nivel microscópico. Como para todas nuestras suposiciones, esta mantendrá o desechara, dependiendo de sí los hechos experimentales indican o no que nuestras predicciones son correctas.
3. - El numero total de moléculas es grande. La dirección y la rapidez del movimiento de cualquiera de las moléculas puede cambiar bruscamente en los choques con las paredes o con otras moléculas. Cualquiera de las moléculas en particular, seguirá una trayectoria de zigzag, debido a dichos choques. Sin embargo, como hay muchas moléculas, suponemos que el gran numero de choques resultante mantiene una distribución total de las velocidades moleculares con un movimiento promedio aleatorio.
4. - El volumen de las moléculas es una fracción despreciablemente pequeña del volumen ocupado por el gas. Aunque hay muchas moléculas, son extremadamente pequeñas. Sabemos que el volumen ocupado por una gas se puede cambiar en un margen muy amplio, con poca dificultad y que, cuando un gas se condensa, el volumen ocupado por el gas comprimido hasta dejarlo en forma líquida puede ser miles de veces menor. Por ejemplo, un gas natural puede licuarse y reducir en 600 veces su volumen.
5. - No actúan fuerzas apreciables sobre las moléculas, excepto durante los choques. En el grado de que esto sea cierto, una molécula se moverá con velocidad uniformemente los choques. Como hemos supuesto que las moléculas sean tan pequeñas, la distancia media entre ellas es grande en comparación con el tamaño de una de las moléculas. De aquí que supongamos que el alcance de las fuerzas moleculares es comparable al tamaño molecular.
6. - Los choques son elásticos y de duración despreciable. En los choques entre las moléculas con las paredes del recipiente se conserva el ímpetu y (suponemos)la energía cinética. Debido a que el tiempo de choque es despreciable comparado con el tiempo que transcurre entre el choque de moléculas, la energía cinética que se convierte en energía potencial durante el choque, queda disponible de nuevo como energía cinética, después de un tiempo tan corto, que podemos ignorar este cambio por completo
LEYES DE LOS GASES
Ley de Boyle-Mariotte
Para una cierta cantidad de gas a temperatura constante, su presión es inversamente proporcional al volumen que ocupa.Matemáticamente sería:
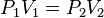
- <perii>p..-2v=p5-v
Ley de Charles
A una presión dada, el volumen ocupado por una cierta cantidad de un gas es directamente proporcional a su temperatura.Matemáticamente la expresión sería:
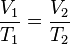 o
o 
Ley de Gay-Lussac
La presión de una cierta cantidad de gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura:Ley de Avogadro
A presión y temperatura constantes, el volumen de cualquier gas es directamente proporcional al número de moles del mismo. O alternativamente, volúmenes iguales de gases diferentes, pero a las mismas presión y temperatura, contienen el mismo número de moléculas.Matemáticamente, la fórmula es:
Ley de los gases ideales
Las tres leyes mencionadas pueden combinarse matemáticamente en la llamada ley general de los gases. Su expresión matemática es:El valor de R depende de las unidades que se estén utilizando:
- R = 0,082 atm·l·K−1·mol−1 si se trabaja con atmósferas y litros
- R = 8,31451 J·K−1·mol−1 si se trabaja en Sistema Internacional de Unidades
- R = 1,987 cal·K−1·mol−1
- R = 8,31451 10−10 erg ·K−1·mol−1
sólo depende del estado actual en que se encuentre el gas.
TIPOS DE GASES
COMBURENTES
OXIGENO Y AIRE | ||
Son gases incoloros, inodoros e insípidos. No arden, pero soportan y aceleran rápidamente la combustión. El  oxígeno forma aproximadamente el 21% del aire atmosférico. Los gases comburentes no arden, pero soportan y aceleran las combustiones. oxígeno forma aproximadamente el 21% del aire atmosférico. Los gases comburentes no arden, pero soportan y aceleran las combustiones. | ||
INERTES
Argón, Nitrógeno, Helio y Dióxido de Carbono | |||||||||||||||||||
Son gases incoloros, inodoros e insípidos. Los gases inertes no reaccionan en condiciones normales. No arden ni soportan la combustión. Pueden provocar asfixia en atmósferas confinadas o poco ventiladas si desplazan el aire. El  argón y el dióxido de carbono son más pesados que el aire y se acumulan en las zonas bajas. El argón y el dióxido de carbono son más pesados que el aire y se acumulan en las zonas bajas. El  nitrógeno forma aproximadamente el 78% de la atmósfera y el nitrógeno forma aproximadamente el 78% de la atmósfera y el  argón el 1%. argón el 1%.
| |||||||||||||||||||


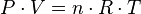
No hay comentarios:
Publicar un comentario